外泌体,这个直径仅30-150纳米的“细胞信使”,正以年复合增长率42.3%(2023-2030)的速度席卷全球生物科技领域。据Grand View Research最新数据,2024年全球外泌体市场规模突破68亿美元,预计2030年将达205亿美元。中国市场虽起步较晚,但增速迅猛,2024年占全球份额3.2%,治疗领域临床试验数量同比激增3倍,被视为精准医疗时代的“现象级”技术。外泌体正从实验室走向产业化,以“纳米级”力量重构医疗、美容、健康管理三大领域,成为下一个万亿级市场风口。
然而,外泌体作为生物科技领域的“明星分子”,在光鲜的数据背后,应用市场却“乱象丛生”。例如部分机构概念滥用,宣称“干细胞外泌体”,夸大效果,但产品活性低、杂质多,甚至含激素,成为医美领域虚假宣传的重灾区。由于行业缺乏统一标准和监管,导致价格虚高。医疗领域中临床试验鱼龙混杂,出现生产不规范、数据造假等现象。外泌体市场的“野蛮生长”,既是技术革命性的必然阶段,也是行业成熟的必经阵痛。随着监管完善与技术下沉,真正具有临床价值的产品将浮出水面,而依靠概念炒作的企业终将被淘汰。在这场纳米级的产业变革中,科学理性与商业伦理的平衡,才是决定行业高度的关键。
干细胞外泌体可抑制炎症因子表达、促进血管新生及胶原合成,在创面修复、抗衰除皱等领域展现出不可替代的潜力。但外泌体若脱离严格质控,将沦为致命风险——日本曾因某“外泌体上清液”产品未执行无菌标准,导致多例败血症及器官衰竭事件,暴露出失控的品控可能引发的灾难性后果。国际监管从“血泪教训”到“标准重构”,2021年成立囊泡治疗产品委员会,2023年发布《外泌体治疗产品共识》,2024年进一步升级质量要求,制定《人源间充质干细胞外泌体制备与检验规范》。随着《外泌体类医疗器械分类界定指导原则》的出台,我国外泌体行业将加速洗牌,具备高纯度制备技术、多中心临床数据及标准化生产体系的企业将脱颖而出。
深圳细胞谷生物医药有限公司按照GMP规范对外泌体生产的全流程进行质量管控,其自主研发的“脐带间充质干细胞囊泡”(INCI编号:38292)(INCI名称:Umbilical Mesenchymal Stem Cell Vesicles ,商品名:CVEXSOTM)正式通过国际化妆品成分命名委员会(INC)审核,并纳入《国际化妆品成分词典和手册》。这一认证标志着细胞谷外泌体品质被国际所认可,也标志着中国企业在化妆品生物活性成分领域实现国际标准突破,为全球抗衰护肤市场注入中国革命性技术力量。细胞谷的外泌体产品正式出海!
本文通过市场上流通的干细胞外泌体的对比,详细阐述从“细胞汤”到“纳米导弹”的工艺及质控突围之路。为从业者提供选型指南,为消费者筑起安全防线。
01
干细胞外泌体的“五维进化”:
从粗放到精细的技术跨越
干细胞外泌体的制备工艺决定其“身份属性”,市场上流通的产品可分为以下五大类,其价值与风险呈显著梯度差异:

02
生产过程与质控对比
1.培养基型外泌体
工艺:无细胞培养环节,依赖商业化培养基。
基础培养基配制 → 直接分装 → 灭菌 → 成品分装
质控:未进行质量控制。
2.细胞上清型外泌体
工艺:细胞复苏 → 常规培养(含血清)→ 收集上清 → 成品分装
个别良心厂家可能会通过低速离心去细胞碎片,在洁净台内通过0.45μm过滤器去除大颗粒。
质控:无质控,一般会标记上总蛋白含量(但蛋白无法反映外泌体的真实含量)。
3.实验室级外泌体
工艺:细胞培养 → 收集上清 → 超速离心或纯化试剂盒→成品分装
①细胞培养:在普通细胞实验室中的生物安全柜培养细胞,常用培养皿、细胞瓶2D贴壁小规模培养细胞,环境易受污染。
②外泌体纯化:常见的有“金标准”超速离心、聚合物沉淀或SEC试剂盒等实验室常用纯化方法,批次差异较大,无法做到全程无菌,且价格昂贵,提取量低。
质控:科研常用的三步鉴定:电镜形态学确认(无法量化)、Western Blot检测三阳一阴标志物(无法量化)、粒径检测。缺乏无菌、内毒素等的安全性质控及活性检测。
4.干细胞副产物外泌体
工艺:干细胞规模化生产→ 废弃上清收集 → 简单的离心纯化→ 冻干 → 粗品
①细胞培养:细胞的GMP车间,生产流程简单、所需空间较小,跟外泌体的GMP车间迥异。在生产工艺上,细胞是目的产物,而外泌体作为细胞产业的“边角料”进行二次回收,存在培养细胞所用的血清、因子、杂蛋白等残留。
②纯化环节:GMP级纯化成本高、且由于上清的浓度低在纯化时损失率极高,因此常用科研的简单离心、过滤等纯化方法,或市售一体化设备、外包等方式,生产转换过多容易造成终产品染菌、及内毒素超标等重大风险。缺乏专门的、放大的纯化工艺,活性不稳定、批次差异大。
③制剂上:无制剂形式,分离后的上清直接手动分装,存在污染风险,亦无长期稳定性研究。
质控:科研常用的三步鉴定,缺乏无菌、内毒素等的安全性质控及活性检测。
5.细胞谷GMP级干细胞外泌体(CVEXSOTM)
工艺:GMP级细胞库建立 → 无血清细胞培养→ 纯化分离 → 多步精纯(SEC+超速离心)→ 纳米级过滤 → 冻干/液氮速冻 → 成品
GMP级原材料与生产环境
①细胞来源:使用认证细胞系(如人源间充质干细胞),提供细胞库溯源文件(如ATCC/ECACC认证)。细胞培养全程监控支原体、细菌、内毒素污染。
②培养基:采用无血清、无异源成分专用培养基。
③生产环境:符合GMP洁净室标准的B+A环境,动态监测尘埃粒子、微生物污染等。
GMP级生产工艺
①细胞培养及制剂:在B+A洁净背景下进行细胞生产,制剂生产采用封闭式无菌灌装机,减少人为干预。
②外泌体分离纯化: 采用多步精纯(SEC+超速离心)、纳米级过滤的方式对外泌体纯化工艺进行革新,经过反复的工艺稳定性确认后,中试三批及大规模生产各项质量参数均符合放行标准。工艺开发及优化文件可查询,关键参数(剪切力、流速、微通道选择、压力时间、温度)均严格记录。
③纯度与完整性:1)粒径分布符合要求,通过动态光散射(DLS)或纳米颗粒跟踪分析(NTA)确认粒径在30-150 nm范围。2)标志物检测合格,CD9/CD63/CD81等外泌体特异性蛋白已经通过Western blot及流式细胞术验证。3)杂质含量可控,层析去除细胞碎片、蛋白质聚集体、游离核酸等,终产品纯度≥90%(通过电镜或BCA法检测)。
最终产品质量标准
①生物活性检测:1)功能验证,通过细胞增殖、迁移或炎症抑制实验评估治疗效果(如分泌抗炎因子IL-10);2)RNA/蛋白质含量,定量检测关键的功能分子(如miRNA-146a、TGF-β)。
②安全性指标:人源病毒检测、无菌性、支原体、内毒素、致热原、遗传毒性等。
③稳定性:加速稳定性试验,检测外泌体结构的完整性和生物活性;冻干制剂验证复溶后的质量一致性。
批次与放行标准
①批次记录:每批次生产记录进行完整追溯(如细胞代数、分离参数、检测数据)。
②放行检测:必检项目:形态(电镜)、粒径、浓度、标志物表达、无菌、内毒素、生物活性;可选项目:免疫原性(如HLA分型)、病毒安全性(如HIV/HCV/HBV核酸检测)等。
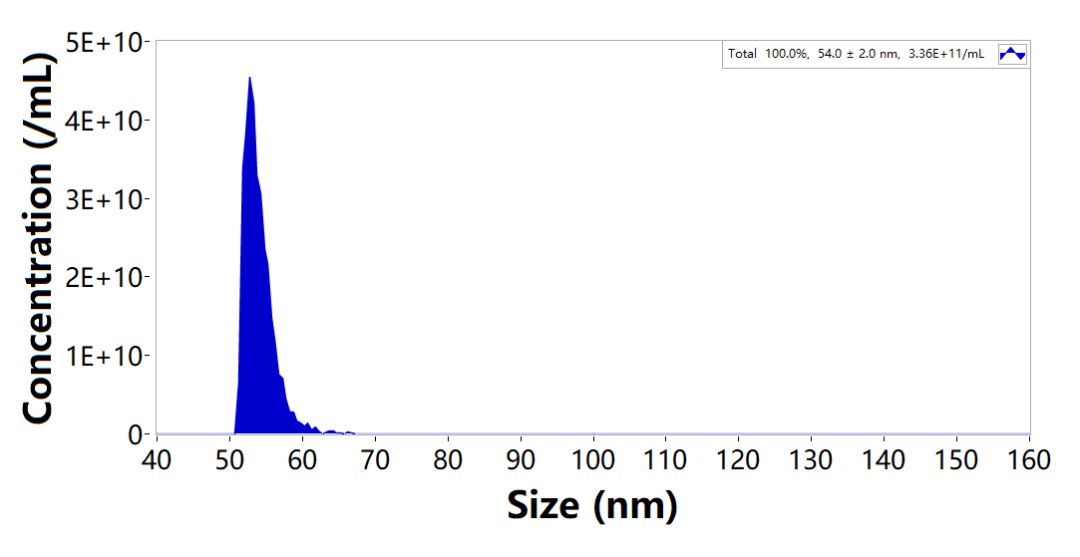
CVEXSOTM外泌颗粒数及粒径分析
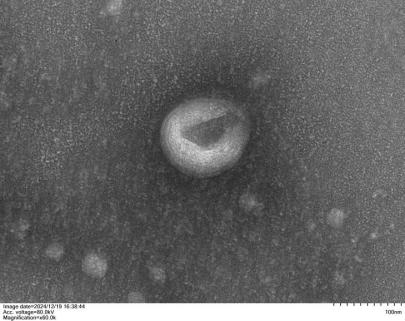
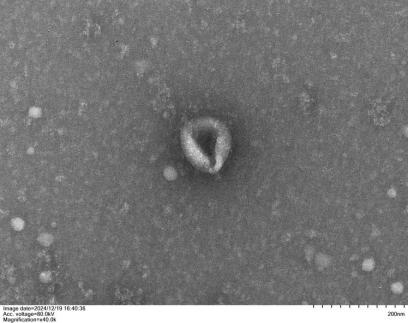

CVEXSOTM外泌体形态检测(TEM)
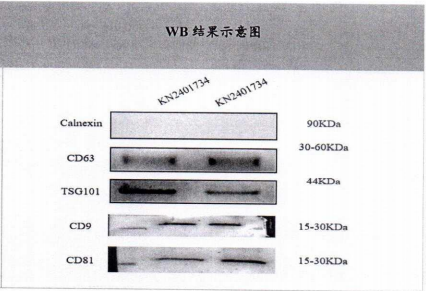
CVEXSOTM外泌体特异性蛋白表(Western blot)

CVEXSOTM外泌体放行质量检测报告
(经美国INC审核认可)
03
应用策略
1. 培养基型外泌体:不建议使用。
2. 细胞上清型外泌体:仅限于科研中的细胞、动物实验,或非临床级生物制剂开发。
3. 实验室级外泌体:可用于科研中的细胞、动物实验,小规模工艺优化等实验;临床使用仅限涂抹外用,防止过敏反应。
4.干细胞副产物外泌体:同实验室级别。应注意使用时易出现安全性风险,且存在活性差、批次间一致性差,供货不稳定等问题。
5. GMP药物级外泌体:临床应用,如水光针、关节注射、头部水光、肺部和鼻腔雾化等;临床治疗,如癌症靶向药物、基因递送载体以及细胞治疗联合疗法等。
04
不合格外泌体风险提示
1. 免疫原性: 异源抗原(如血清蛋白污染)会引起严重的超敏反应。
2. 基因污染:一般残留的gDNA(>100bp)通过TLR9通路激活NF-κB,导致IL-6分泌增加3倍,引起免疫反应。
3. 毒性物质残留:代谢废物或分离试剂会抑制巨噬细胞吞噬功能,影响免疫调节效果。
4.疗效反噬:未经严格纯化的外泌体,残留的凋亡小体可能传递细胞凋亡信号,导致组织硬化。
5.败血症:无菌、内毒素等含量超标会导致败血症,甚至死亡。
05
外泌体的选择指南
1.看包装:尽量选择药品级的西林瓶包装,密封性强,可做长期保存。如果是冻存管等塑料管包装的,一般为溶液,储存在-80℃冰箱,复溶后尽快使用才可保证外泌体活性,不可长期、常温存储,存在安全隐患。且外包装有明确成分、批号、有效期等信息。
2.外观与颜色:透明/淡黄色,天然干细胞外泌体通常为透明或淡黄色液体(如脐带间充质干细胞来源),无明显浑浊或沉淀。若浑浊或有絮状沉淀,可能为污染或降解,需谨慎。无异常颜色,若产品呈红色、粉色等鲜艳色彩,可能为培养基残留或添加色素,需警惕。
3.闻气味:近闻无味。如果能闻到气味(比如苏打水、香气、酵母的气味或淡淡的腥味)都不是真正的外泌体。
4.看COA:查随行的质检报告(CoA),应含有外泌体的颗粒数量、批号、生产日期、安全性检测数据(无菌、支原体、内毒素等)、标志物、蛋白浓度等信息。
5.资质合规性:国际认证:①FDA/NMPA认证:临床应用需通过FDA的IND/CTA或中国NMPA注册;②DMF备案:美国市场需提交药物主文件,涵盖生产工艺、质控标准;③INC等审核:国际权威机构审核,并纳入国际化妆品名录,国际互认才可出口。研发实力:查看专利技术及合作实验室资质。
6.其他注意事项:储存与运输(液态外泌体需全程-80℃冷链运输);价格与来源,警惕低价陷阱,避免“三无”产品。
06
未来展望:从“小众”到“主流”
外泌体的出现,让人类对生命修复的认知从“细胞层面”迈向“分子层面”。选择合规产品,就是选择与前沿科学同行。外泌体不是“万能神药”,但其革命性的生物学特性已为人类健康打开新窗口。随着技术突破与监管完善,选择科学验证的优质产品,才能真正拥抱这场“纳米级”的健康变革。未来已来,你准备好了吗?
END


微信公众号

市场部:赖女士
全国统一服务热线
400-800-1266
了解更多内容请登录
www.sz-cell.com
 扫一扫,关注我们最新消息
扫一扫,关注我们最新消息 工作时间:周一至周五 9:00-18:00
联系人:赖女士
手机:13670105633
邮件:laijiaqi@sz-cell.com
地址:深圳市坪山区坑梓街道金沙社区荣田路1号海普瑞生物医药生态园
